유럽종양학회(ESMO24) 학술대회를 준비하며 OBiS Insights 무료 사전 보고서 발표
OBiS Insights 사전 회의 ESMO24 보고서는 아직 승인되지 않은 새로운 암 약물을 분류하기 위해 2,960개의 초록 제목에 대한 검토를 기반으로 합니다.
NEW YORK, NY, UNITED STATES, September 12, 2024 /EINPresswire.com/ -- 뉴욕시에 본사를 둔 의료 분석 컨설팅 회사인 OBiS는 다가오는 유럽종양학회(ESMO) 학술대회를 앞두고 사전 보고서를 개발했습니다. 이 보고서는 2,960개의 초록 제목을 검토한 결과, 승인되지 않은 275개의 신약에 대한 분석을 기반으로 작성되었습니다. 보고서는 아래 링크에서 무료로 다운로드할 수 있습니다.
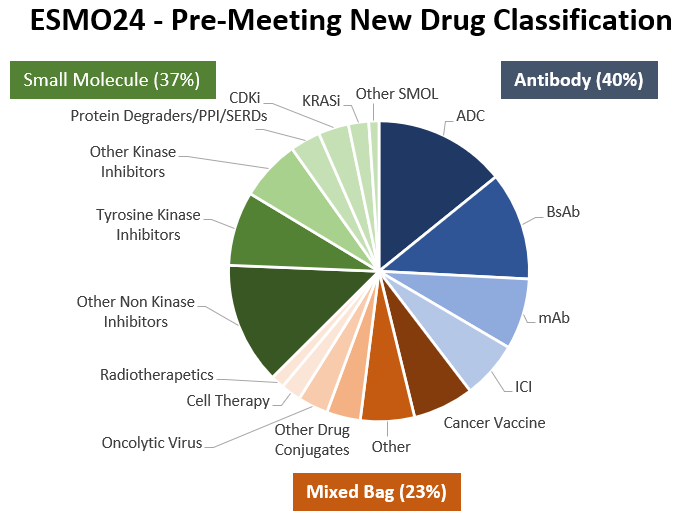
40% (109개) 항체 기반 약물: 항체-약물 접합체(39개), 이중 특이 항체(32개), 기타 단일클론 항체(21개), 면역 체크포인트 억제제(17개)
37% (103개) 소분자 약물: 비키나제 억제제(36개), 티로신 키나제 억제제(22개), 기타 키나제 억제제(18개), 단백질 분해제/PPI/SERDs(9개), CDK 억제제(9개), KRAS 억제제(6개), 기타 소분자 약물(3개)
23% (63개) "혼합형" 약물: 암 백신(18개), 기타 혼합형 약물(16개), 기타 약물 접합체(10개), 온콜리틱 바이러스(9개), 세포 치료제(6개), 방사선 치료제(4개)
중요 참고 사항: OBiS Insights 사전 보고서에는 초록 제목에 명시적으로 언급되지 않은 약물이 포함되지 않습니다. 이 보고서는 학회 진행에 따라 업데이트될 예정입니다. 또한, 카테고리 간의 중복이나 예외 사항이 보고서에 일부 포함될 수 있습니다.
OBiS Insights 보고서에는 최근 ASCO24 연례 학술대회 및 일본 요코하마에서 열린 ASCO24BT 회의의 주요 통찰력 요약도 포함되어 있습니다. ESMO24에서 발표될 275개의 약물 중 118개(43%)는 이러한 ASCO 회의에서 이미 논의되었습니다.
또한, 2024년 8월 20일 기준으로 중국에서 승인되었으나 미국 또는 유럽에서는 아직 승인되지 않은 카두닐리맙, 도나페닙, 플루마티닙, 펜푸리맙, 피로티닙, 서플루리맙, 신틸리맙, 베브렐티닙 등의 여러 암 치료제는 이번 보고서에 포함되지 않았지만, 추후 업데이트에서 다룰 가능성이 있습니다.
OBiS에 대하여
OBiS는 뉴욕시에 본사를 둔 민간 의료 분석 회사로, 사업 개발, 예측, 신제품 기획, 주요 의견 리더 식별, 시장 조사, 임상 시험 모집 분석, 맞춤형 데이터 서비스를 전문으로 합니다. OBiS는 검증된 AI 기반 분석을 개발하여 생명공학 및 제약 회사에 서비스를 제공합니다. 2002년, 브리스톨 마이어스 스퀴브의 종양학 시장 조사 책임자였던 릭 비즐리에 의해 설립되었으며, 2020년 프랑스 올롱생트마리에도 자회사를 설립하였습니다.
면책 조항
이 보도 자료에 포함된 정보는 교육 목적으로만 제공되며, 의료 또는 재정적 투자 조언을 제공하려는 목적이 아닙니다.
Richard Beasley
OBIS
+1 646-988-7679
email us here
Distribution channels: Conferences & Trade Fairs, Education, Healthcare & Pharmaceuticals Industry, Science, Technology
Legal Disclaimer:
EIN Presswire provides this news content "as is" without warranty of any kind. We do not accept any responsibility or liability for the accuracy, content, images, videos, licenses, completeness, legality, or reliability of the information contained in this article. If you have any complaints or copyright issues related to this article, kindly contact the author above.
Submit your press release